Prosegui nella lettura di questo approfondimento di BioService per conoscere da vicino cos’è il database EUDAMED, qual è il suo obiettivo ed essere aggiornato su tutti gli step per il suo utilizzo.
Indice
1. Che cos’è EUDAMED?2. Un sistema multiscopo e interoperabile
3. EUDAMED è già in uso?
4. In conclusione
Che cos'è EUDAMED?
EUDAMED (European database on medical devices) è un sistema che si sostanzia in una banca dati per dispositivi medici a livello europeo multiscopo e interoperabile. Si tratta di un sistema collaborativo di registrazione, notifica e divulgazione delle informazioni disponibili in parte anche al pubblico. Il tutto con l’obiettivo di rendere più trasparente e migliorare la condivisione delle informazioni sui dispositivi medici a livello europeo.
Un sistema multiscopo e interoperabile
Abbiamo visto che il database EUDAMED si caratterizza per il fatto di essere multiscopo e interoperabile. Ma a che cosa ci riferiamo esattamente con questi due termini?
L'interoperabilità deriva dal fatto che diversi soggetti possono interagire con la piattaforma caricando le informazioni richieste dalla normativa europea. Ci si riferisce, in questo caso, agli attori definiti nell’MDR (quali fabbricante, mandatario, importatore e distributore) e agli Enti Notificati. Tuttavia, anche odontoiatri, odontotecnici e i pazienti stessi possono accedere a tali dati per la consultazione.
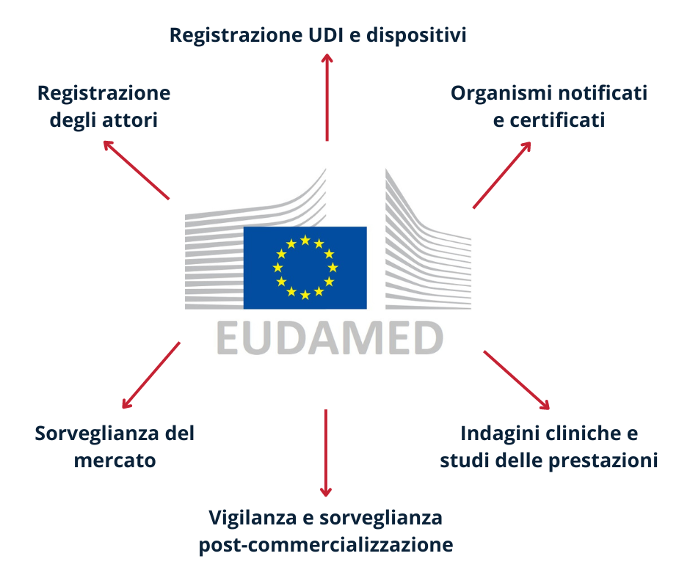
Per quanto concerne invece il multiscopo, si deve fare riferimento alla configurazione finale della banca dati, che sarà costituita da un unico sito web, il quale rimanda a sei diversi sistemi elettronici (i cosiddetti “moduli”) interconnessi tra loro:
L'interoperabilità deriva dal fatto che diversi soggetti possono interagire con la piattaforma caricando le informazioni richieste dalla normativa europea. Ci si riferisce, in questo caso, agli attori definiti nell’MDR (quali fabbricante, mandatario, importatore e distributore) e agli Enti Notificati. Tuttavia, anche odontoiatri, odontotecnici e i pazienti stessi possono accedere a tali dati per la consultazione.
Per quanto concerne invece il multiscopo, si deve fare riferimento alla configurazione finale della banca dati, che sarà costituita da un unico sito web, il quale rimanda a sei diversi sistemi elettronici (i cosiddetti “moduli”) interconnessi tra loro:
- registrazione degli attori;
- registrazione UDI e dispositivi;
- organismi notificati e certificati;
- indagini cliniche e studi delle prestazioni;
- vigilanza e sorveglianza post-commercializzazione;
- sorveglianza del mercato.
EUDAMED è già in uso?
È importante sottolineare che la piena operatività di EUDAMED non è ancora stata raggiunta, così come il suo carattere obbligatorio.
Dei sei moduli che compongono il sistema, solo tre sono attualmente operativi: il modulo sulla registrazione degli attori, quello sulla registrazione dei dispositivi medici e dei loro UDI e quello per gli Enti notificati.
Solo quando il sistema sarà completamente funzionante e si provvederà all’avviso della piena funzionalità da pubblicarsi in Gazzetta Ufficiale, l’articolo 34 paragrafo 3 dell’MDR stabilisce un periodo di 24 mesi entro il quale vanno espletati tutti gli obblighi di registrazione dei dispositivi medici e dei certificati.
Dei sei moduli che compongono il sistema, solo tre sono attualmente operativi: il modulo sulla registrazione degli attori, quello sulla registrazione dei dispositivi medici e dei loro UDI e quello per gli Enti notificati.
Solo quando il sistema sarà completamente funzionante e si provvederà all’avviso della piena funzionalità da pubblicarsi in Gazzetta Ufficiale, l’articolo 34 paragrafo 3 dell’MDR stabilisce un periodo di 24 mesi entro il quale vanno espletati tutti gli obblighi di registrazione dei dispositivi medici e dei certificati.
In conclusione
Ad oggi, quindi, EUDAMED presenta una funzionalità e un uso meramente volontario. Ciò nonostante BioService, sempre attenta alle necessità dei propri clienti e agli obblighi imposti per una migliore trasparenza dei dispositivi medici, ha già provveduto alla propria registrazione come fabbricante, completando a breve anche le ingenti richieste del secondo modulo.
Continua a seguirci per non perdere gli aggiornamenti in merito al Regolamento UE 2017/745 (MDR) e le ultime novità sulla Qualità Aziendale BioService!
Continua a seguirci per non perdere gli aggiornamenti in merito al Regolamento UE 2017/745 (MDR) e le ultime novità sulla Qualità Aziendale BioService!

